酶的结构和功能,酶是由活细胞产生,对其底物具有高度特异性和高度催化效能的蛋白质或者是RNA。酶可以使复杂的物质代谢有条不紊的进行,使物质代谢与正常的生理机能相适应,下面就来看看酶的结构和功能。
酶的结构和功能1
酶的辅助因子一般包括辅酶、辅基和金属离子。许多辅酶和辅基为水溶性维生素的衍生物。
根据酶蛋白本身结构的特征,酶可分为单体酶、寡聚酶和多酶复合物。只由一条肽链组成,但同时具有多个酶活性的酶称为多功能酶。酶只能催化热力学允许的反应,不改变平衡常数。
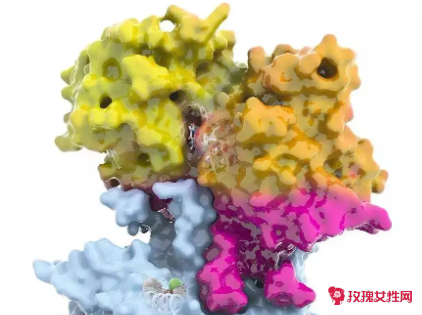
酶的活性中心是指酶分子上直接与底物结合,并与催化作用直接相关的区域。活性中心由结合基团和催化基团组成。活性中心通常为酶分子表面的一个裂缝、空隙或口袋,活性中心内多为疏水氨基酸残基,但行使催化功能的是亲水氨基酸残基。底物结合的特异性取决于其与底物之间在结构上一定程度的互补性。
酶的专一性可分为绝对专一性、基团专一性、键专一性和立体专一性可使用“锁与钥匙”学说和“诱导契合”学说解释酶作用的专一性。可使用“三点附着”模型和“四点定位”模型解释酶为什么能够区分对映异构体以及一个假手性C上两个一样的基团。酶的反应速率一般以单位时间内底物或产物浓度的变化值来表示。
影响酶促反应速率的主要因素有底物或产物浓度,酶浓度,底物浓度,反应温度,pH,离子浓度,以及有无抑制剂或激活剂的存在。
酶反应的米氏动力学假定反应速率为初速率,酶底物复合物处于稳态和符合质量作用定律,
Km是指酶反应初速率为Vmax一半时底物的浓度。一个酶的Km越大,意味着该酶与底物的亲和力越低;酶的转化数是指在单位时间内一个酶分子将底物转变城产物的分子总数,Kcat/Km通常用来衡量酶的催化效率。
酶的抑制剂可分为可逆性抑制剂和不可逆性抑制剂。可逆性抑制剂以次级键与酶可逆性结合,使用透析或超滤就可除去,使酶恢复活性,不可逆性抑制剂以强的化学键与酶结合,导致酶的有效浓度降低。
竞争性抑制剂不改变Vmax,但能提高Km;非竞争性抑制剂不改变酶的Km,降低Vmax;反竞争性抑制剂能降低酶的Km,降低Vmax。与不可逆性抑制剂动力学曲线相似的可逆性抑制剂是反竞争性抑制剂。
基团特异性抑制剂在结构上与底物无相似之处,但能共价修饰酶活性中心上的必须侧链基团而导致酶活性不可逆性失活;自杀性抑制剂是受酶自身激活的不可逆性抑制剂。
多底物反应动力学机制一般可以分为序列机制合乒乓机制。使用Cleland作图法能清楚地反映出多底物反应中底物结合和产物释放的先后关系。
别构酶除了含有活性中心外,还有别构中心。一种典型的别构酶的反应速率对底物浓度曲线为S性,对竞争性抑制剂的.作用表现双相反应。
使用Hill方程能很好说明别构酶的动力学,Hill方程与米氏方程的主要差别首先是Hill方程中的底物浓度被提高到h数量级,h被称为Hill系数;其次,方程中以K0.5取代Km,该常数也被提高到h数量级。h>1,则速率对底物浓度作图呈S曲线,酶具有正底物协同性;h<1则意味着酶具有负底物协同性,正协同效应意味着酶对环境中底物浓度的变化更为敏感。
被酶学家用来解释各种酶催化机制的学说是过渡态稳定学说。相关的催化策略包括邻近定向效应、广义酸碱催化、静电催化、和底物形变。形成酶与底物共价中间物手段主要是亲核催化也有亲电催化。
所有的蛋白酶在催化过程中都经历四面体的过渡态,该过渡态形成的原因是一个亲核基团进攻肽键的羰基碳。溶菌酶的催化机制有广义的酸碱催化,静电催化和底物形变。
可使用齐变学说和序变学说解释别构酶的动力学行为,这两种学说都认为酶具有T态和R态,活性高的是R态。不能解释负协同效应的学说是齐变学说。
酶的结构和功能2
酶(enzyme)是由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质或RNA。酶的催化作用有赖于酶分子的一级结构及空间结构的完整。若酶分子变性或亚基解聚均可导致酶活性丧失。酶属生物大分子,分子质量至少在1万以上,大的可达百万。
酶是一类极为重要的生物催化剂(biocatalyst)。由于酶的作用,生物体内的化学反应在极为温和的条件下也能高效和特异地进行。
随着人们对酶分子的结构与功能、酶促反应动力学等研究的深入和发展,逐步形成酶学(enzymology)这一学科。
酶的化学本质是蛋白质(protein)或RNA(Ribonucleic Acid),因此它也具有一级、二级、三级,乃至四级结构。按其分子组成的不同,可分为单纯酶和结合酶。仅含有蛋白质的称为单纯酶;结合酶则由酶蛋白和辅助因子组成。例如,大多数水解酶单纯由蛋白质组成;黄素单核苷酸酶则由酶蛋白和辅助因子组成。结合酶中的酶蛋白为蛋白质部分,辅助因子为非蛋白质部分,只有两者结合成全酶才具有催化活性。
酶具有不同于一般催化剂的显著特点:酶对底物具有高度特异性,高度催化效率。酶具有可调节性及不稳定性。
酶的`组成
按照酶的化学组成可将酶分为单纯酶和结合酶两类。单纯酶分子是水解后仅有氨基酸组分的酶。结合酶分子则是由蛋白质部分和非蛋白质部分共同组成,如金属离子、铁卟啉或含B族维生素的小分子有机物。结合酶的蛋白质部分称为酶蛋白(apoenzyme),非蛋白质部分统称为辅助因子(cofactor),两者一起组成全酶(holoenzyme);只有全酶才有催化活性,如果两者分开则酶活力消失。
非蛋白质部分如铁卟啉或含B族维生素的化合物若与酶蛋白以共价键相连的称为辅基(prosthetic group),用透析或超滤等方法不能使它们与酶蛋白分开;反之两者以非共价键相连的称为辅酶(coenzyme),可用上述方法把两者分开。辅助因子有两大类,一类是金属离子,且常为辅基,起传递电子的作用;另一类是小分子有机化合物,主要参与传递氢原子、电子或某些化学基团或起运载体的作用。